Por Annia Galano
Sabemos que si congelamos agua se convierte en hielo, que no es más que esta misma sustancia en estado sólido. Aunque, para ser estrictos, deberíamos decir en estado de agregación sólido. También sabemos que el hielo ocupa más volumen que el agua. Por eso, si ponemos a congelar una botella de agua, esta puede llegar a explotar. El hielo no cabe donde cabía la misma cantidad de agua. También sabemos que el hielo flota sobre el agua. Hemos visto los trozos que, aún si los empujamos hasta el fondo, regresan tercos a la superficie. La razón, muchas veces escuchada, es que esto ocurre porque el hielo es menos denso que el agua.
Pero ¿qué es la densidad? Es la relación entre masa y volumen. De modo que, si una misma cantidad de agua al convertirse en hielo ocupa mayor volumen, quiere decir que una unidad de volumen de hielo (por ejemplo, un centímetro cúbico) pesa menos que la misma unidad de volumen de agua y, claro, por eso flota. Probablemente esto ya lo sabían. Lo interesante, quizás, es por qué el hielo es menos denso que el agua. Para la mayoría de las sustancias sucede lo contrario. El estado de agregación sólido es más denso que el líquido, ya que en el primer caso las moléculas se encuentran más cerca unas de otras. Apretujadas, como si viajaran en el metro mañanero. En el mismo espacio hay más moléculas y la sustancia pesa más.
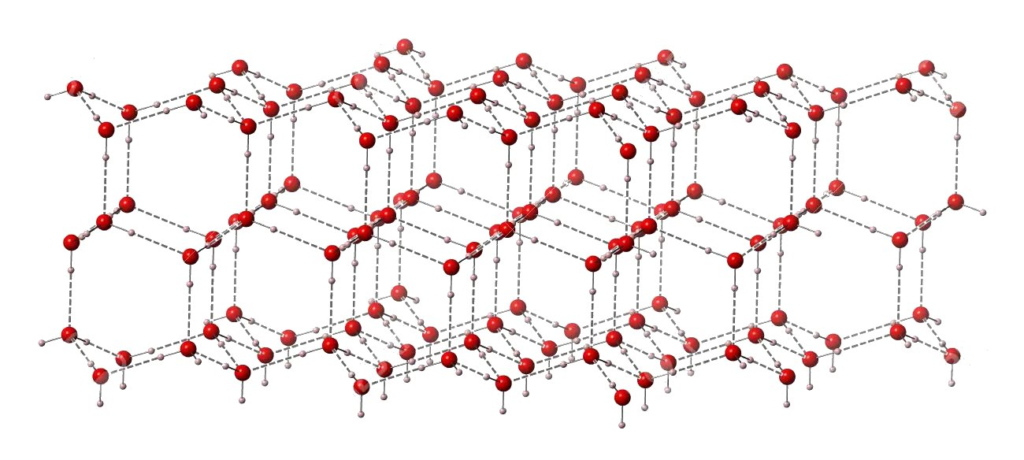
¿Qué sucede con el hielo que se comporta diferente, como si en su metro particular hubiera asientos libres en las mañanas? El hielo tiene una estructura peculiar, en la que las moléculas de agua se acomodan de modo que los átomos de hidrógeno de una apuntan hacia el oxígeno de sus vecinas y viceversa, formando lo que conocemos como puentes de hidrógeno. Esto sucede porque en cada molécula de agua el átomo de oxígeno tiene una cierta carga negativa, mientras que los átomos de hidrógeno tienen una cierta carga positiva. Y los opuestos se atraen. El mundo de las moléculas no es una excepción.
Para maximizar las interacciones entre cargas de signos opuestos, los arreglos óptimos tienen espacios vacíos (asientos desocupados en nuestra metáfora). Son como largos pasadizos o canales donde no hay nada y, lógicamente, no aportan masa (Figura 1). Esos túneles vacíos en el hielo son los responsables de que este pese menos que el agua líquida y desordenada, donde no hay asientos disponibles, sino un tumulto de moléculas en constante movimiento.
Ya entendimos por qué el hielo flota sobre el agua. Pero ¿qué pasaría si no fuera así? Si se fuera al fondo de nuestra limonada veraniega no sería un problema. Sin embargo, la vida en océanos, lagos o cualquier otro cuerpo de agua se vería terriblemente afectada. Imaginen, si el hielo se fuera al fondo, ¡los organismos acuáticos morirían congelados en invierno! De hecho, el mar se congelaría completamente, el hielo continuaría formándose en la superficie fría y cayendo al fondo. Esto no pasa justo porque, como el hielo flota, se forma una capa superficial que separa el agua bajo él de las frías temperaturas ambientales. Gracias a esta capa, el agua protegida por el hielo se mantiene líquida y la vida acuática a salvo.
Además de proteger la vida de peces y otros organismos acuáticos, ¿qué otro papel importante tiene el hielo? Es responsable de preservar el equilibrio de temperatura necesario para que se mantenga la vida en el planeta Tierra. Y ustedes dirán, si pasamos por tórridos veranos y gélidos inviernos, ¿de qué temperatura estable me estás hablando? Para responder esta pregunta, haremos un poco de historia. Una historia muy, muy, antigua.
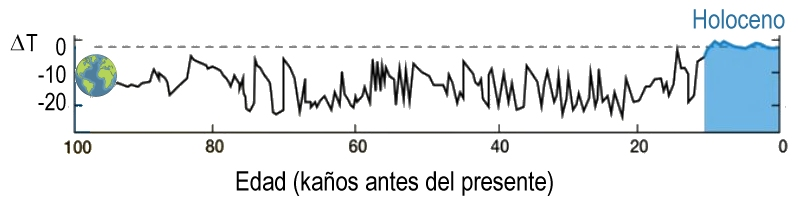
Ante todo, quiero aclarar que hablo de la temperatura media global del planeta. O sea, de la temperatura promedio considerando todas sus regiones, según la estiman los geólogos. Esta temperatura varió por miles de años antes de alcanzar su fase estable, conocida como Holoceno. El Holoceno comenzó hace diez mil años, después de la última glaciación o glaciación Würm, también llamada Edad de Hielo, último periodo glacial de la historia geológica de la Tierra. Y la Tierra existe gracias a este periodo de temperaturas estables. Es el único en el que la temperatura media global se ha mantenido dentro del límite de ±1°C (Figura 2). Esto es lo que ha permitido el equilibrio ambiental y el desarrollo de los seres humanos.
Y ustedes se preguntarán a qué viene todo esto si estábamos hablando del hielo. El hielo de los casquetes polares en el Ártico y la Antártida son responsables de esta calma térmica y por tanto de la estabilidad de la Tierra. Su blanca superficie refleja entre el 90 y el 95% de la radiación solar que incide sobre él, y la envía de regreso al espacio interestelar, lo que evita que el planeta se caliente. Sabemos que la ropa oscura da más calor que la ropa blanca bajo el sol del verano. Con la Tierra sucede igual.
Grandes propiedades se esconden tras las cosas más simples. Esos cubitos transparentes, blanquecinos, a los que apenas prestamos atención cuando enfrían nuestras bebidas, representan a un gran héroe ambiental de estructura compleja y organizada. No me queda nada más por decir que: ¡Gracias, hielo, por salvaguardar la vida en nuestro planeta!


1 Comment
¡Gran artículo, muy interesante!